Molekulės ir atomai
Pamokos veikla.
Susipažįsta su molekulėmis, atomais.
Išsiaiškinti molekulės ir atomo sandarą, medžiagų būsenas. Molekulės ir atomai http://gamta5-6.mkp.emokykla.lt/lt/mo/laboratorija/atomai_ir_molekules/
Molekulė
. Demonstracijoje nagrinėdami vandens sandarą išsiaiškinsite, kad medžiagos sudarytos iš dalelių. Matysite, kaip sudarytos vandens molekulės, kaip jos juda ir koks jų išsidėstymas. http://gamta5-6.mkp.emokykla.lt/lt/mo/demonstracijos/molekule/
____________________________
Kaip sudaryti atomai http://gamta7-8.mkp.emokykla.lt/lt/mo/demonstracijos/kaip_mokytis_gamtos_mokslu/
Atomas. Išsiaiškinsite, kad visos medžiagos yra sudarytos iš dalelių (atomų). http://gamta5-6.mkp.emokykla.lt/lt/mo/demonstracijos/atomas/
____________________________
Jeigu atomus sudaro beveik vien tuštuma, kodėl pro medžiagas negalime eiti arba matyti jas kiaurai?
____________________________
Atomo sudėtis http://www.freezeray.com/flashFiles/AtomsAndIons.swf
Perskaityti Molekulės ir atomai. (52 psl.) . Atlikti 1-10 užduotis (55 psl.). Gali paruošti pranešimą „Medžiagų būsenos. Molekulės. Atomai“
Molekulės ir atomai.
Daugelį fizikinių reiškinių, medžiagų savybių galima paaiškinti padarius prielaidą, kad medžiagos sudarytos iš dalelių, tarp kurių yra tarpai. Kasdien susiduriame su daugybe kūnų, kurie iš pirmo žvilgsnio atrodo ištisiniai. Ar iš tikrųjų taip yra?
Bandymas. Paimkime sausą plytą ar kreidos gabaliuką ir užlašinkime ant jo vandens. Matome, kad plyta arba kreida sugeria vandenį. Šie bandymai rodo, kad kūnai yra akyti, taigi jie patvirtina skyrelio pradžioje pateiktą prielaidą, jog medžiagos sudarytos iš dalelių, tarp kurių yra tarpai.
Kadangi medžiagų yra nepaprastai daug, tai gausi ir molekulių įvairovė. Medžiagos molekulės yra tokios mažos, kad jų dydį sunku net įsivaizduoti.
Molekulių skersmuo siekia apie 0,1–1 nm. 1 000 000–10 000 000 molekulių, sudėtų viena šalia kitos, tilptų 1 mm ilgio atkarpoje.
Įvairių medžiagų molekulės yra nevienodo dydžio (prisiminkite: vienos iš smulkiausių yra vandenilio molekulės, o vienos iš stambiausių – baltymų molekulės), tuo tarpu tos pačios medžiagos visos molekulės vienodos ir nė viena kita medžiaga nėra sudaryta iš tokių molekulių.
Atomai.
Kad ir kokios mažos yra molekulės, tačiau jas galima suskaidyti į dar smulkesnes daleles, vadinamas atomais (gr. atomos – nedalus). Vyksta ir atvirkščias procesas – atomai jungiasi vieni su kitais, sudarydami molekules. Molekulės gali būti sudarytos iš vienos rūšies arba skirtingų rūšių atomų, be to, gali skirtis ir atomų skaičius molekulėje. Pavyzdžiui, deguonies arba vandenilio molekulė susideda iš dviejų (vienodų) atomų, vandens molekulė – iš trijų atomų: dviejų vandenilio ir vieno deguonies, baltymų molekulė – iš dešimčių ar net šimtų tūkstančių atomų. Molekules galime pavaizduoti schemiškai (3.6 pav.). Šis jų vaizdavimas vadinamas molekulės modeliu.
Tos pačios rūšies atomai vadinami cheminiais elementais. Vadinasi, atomas yra mažiausia cheminio elemento dalelė. Šiuo metu atomų yra žinoma per 110 skirtingų rūšių. Kyla klausimas: jeigu skirtingų atomų yra vos per 110, tai kodėl gamtoje taip gausu iš jų sudarytų medžiagų (prisiminkime: jų yra daugiau kaip 13 milijonų)? Viskas labai paprasta. Medžiagų įvairovę lemia skirtingas atomų skaičius molekulėje bei įvairūs tų atomų deriniai.
Kaip iš 32-iejų mūsų abėcėlės raidžių galima sudėti nepaprastai daug žodžių, taip ir iš 110 atomų pavyksta sudaryti gausybę medžiagų.
Atomo sandara
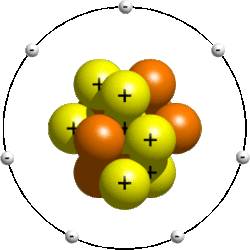
Atomai taip pat nėra nedalomi, jie susideda iš dar smulkesnių dalelių, vadinamų protonais, neutronais ir elektronais. Jų skaičius įvairiuose atomuose yra skirtingas. Protonai ir neutronai, sudarantys 99,9 % atomo masės, yra susitelkę mažytėje atomo tūrio dalyje – atomo centre. Jie sudaro atomo branduolį. Aplink jį didžiuliais greičiais nuolat skrieja elektronai.
Protonai ir elektronai turi ypatingą savybę – elektros krūvį. Plačiau apie jį kalbėsime aukštesnėse klasėse, o dabar pakaks žinoti, jog protono elektros krūvis yra teigiamas, elektrono – tokio pat dydžio, bet neigiamas.
Dalelės, turinčios elektros krūvį, dar vadinamos elektringosiomis dalelėmis. Neutronas elektros krūvio neturi, sakoma, kad jis yra neutralus. Įprastinėmis sąlygomis neutralus yra ir atomas, nes teigiamasis branduolio (protonų) krūvis lygus neigiamajam elektronų krūviui.
Schemiškai pavaizdavę sudedamąsias atomo daleles, gauname atomo modelį, kuris kartais vadinamas planetiniu, nes primena Saulės sistemos sandarą.
Elektronas skriedamas gali kai kada atitrūkti nuo atomo ir tada šis pasidaro jau nebeneutralus – įgyja teigiamąjį krūvį. Vieno ar kelių elektronų netekęs atomas virsta teigiamuoju jonu. Prisijungęs vieną ar keletą elektronų, neutralus atomas įgyja neigiamąjį krūvį ir virsta neigiamuoju jonu. Kai kurios medžiagos (metalai, druskos) sudarytos ne iš molekulių arba atomų, bet iš jonų.